E aí, pessoal?! Hoje o Super Vestibular traz para você mais uma importante dica de Química para o Enem. Falaremos sobre o tema: Ácido-base.
Os ácidos e as bases são assuntos inicialmente estudados em Química Inorgânica, pois são duas funções inorgânicas. Segundo a teoria da dissociação iônica de Arrhenius, os ácidos são compostos covalentes (moleculares) que reagem com água, sofrendo ionização e formando soluções que apresentam como único cátion o hidrogênio (H+), ou, mais corretamente, o cátion hidrônio ( H3O+). Já as bases são compostos capazes de dissociar-se em água, liberando íons, dos quais o único ânion é o hidróxido, OH-.
Os ácidos possuem pH menor que sete, e as bases possuem pH maior que sete. Esses dois tipos de compostos podem reagir entre si, neutralizando um ao outro, isto é, tornando o pH do meio neutro (pH = 7). Isso ocorre porque o cátion H+ proveniente do ácido reage com o ânion OH- proveniente da base, formando água. Esse tipo de reação é chamado de reação de neutralização e produz, além da água, um sal.
Além disso, em Química Inorgânica, são estudadas também outras duas funções: os sais e os óxidos, que também podem ser classificados como sais ou óxidos ácidos ou básicos. Veja como isso é determinado nos textos Classificação dos óxidos e Classificação dos sais.
Essa relação ácido-base está presente em várias facetas do nosso cotidiano e envolve outros conteúdos de Química, tais como o deslocamento do equilíbrio químico segundo o Princípio de Le Chatelier, determinadas reações orgânicas, pH, indicadores ácido-base, titulação ácido-base, entre outros.
Por isso, o Enem muitas vezes traz questões que abordam essa relação ácido-base no cotidiano. Vejamos alguns exemplos:
Exemplo 1: Enem 2013 - Neutralização:

Questão 69 do Enem 2013 do caderno azul
Resolução:
Alternativa "e".
A reação descrita no enunciado da questão origina um ácido forte (o ácido sulfúrico – H2SO4) e um sal (Fe2(SO4)3), que, em meio aquoso, sofre hidrólise, formando um ácido forte.
Assim, para corrigir os problemas ambientais causados por essa drenagem, é preciso neutralizar o meio através do acréscimo de alguma substância básica. É o caso do carbonato de cálcio (CaCO3), que é um sal básico. Sabemos disso porque ele é formado por uma base forte e um ácido forte:
* CaCO3: cátion → Ca2+ (vem do hidróxido de cálcio, Ca(OH)2, uma base forte);
ânion → CO32- (vem do ácido carbônico, H2CO3, um ácido fraco).
Ao reagir com a água do meio, sofre hidrólise, produzindo o hidróxido de cálcio — a base forte que neutraliza o meio. O outro produto é o ácido carbônico, que se degrada e deixa o meio básico:
CaCO3(s) + H2O(l) ↔ Ca(OH)2 + H2CO3 ↔ Ca(OH)2 + CO2(g) + H2O(l)
Exemplo 1: Enem 2012 – Neutralização e pH:
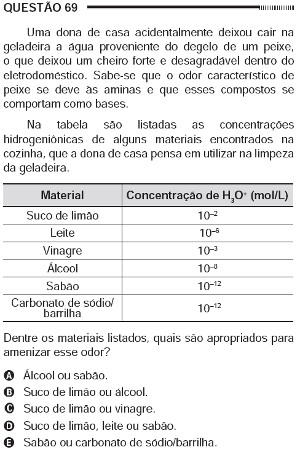
Questão 69 do Enem 2012 do caderno azul
Resolução:
Alternativa "c".
O enunciado da questão diz que o cheiro forte e desagradável dentro da geladeira é proveniente das aminas, que são básicas (se desejar, leia o texto Classificação e basicidade das aminas). Assim, para amenizar o odor, é preciso utilizar substâncias ácidas para neutralizar o meio. Entre as opções apontadas nas alternativas, sabe-se que o limão e o vinagre (ácido acético) são ácidos.
Além disso, a tabela dada mostra que a concentração de íons H3O+ é, respectivamente, 10-2 e 10-3, o que significa que o pH deles é igual a 2 e 3, por isso são bastante ácidos (as substâncias ácidas possuem pH menor que sete).







