E aí, pessoal? Estudando bastante para o Enem? É claro que o conteúdo de Eletroquímica não poderia ficar de fora, não é mesmo?! Por isso, a dica de Química para o Enem do Super Vestibular de hoje é exatamente sobre essa matéria importante.
Visto que a Química está inserida na área de Ciências da Natureza e suas Tecnologias, o Enem geralmente cobra conteúdos que envolvam situações-problema relacionadas com impactos ambientais, desenvolvimento da sociedade e situações do cotidiano.
Por essa razão, a Eletroquímica tem grande potencial de cair no Enem porque ela trata da transformação de energia química em energia elétrica (pilhas e baterias) ou o processo contrário, transformação de energia elétrica em energia química (eletrólise), que são aspectos muito presentes em nossas vidas.
Veja a seguir alguns aspectos ambientais, sociais e econômicos que podem ser relacionados com os conteúdos de Eletroquímica no Enem:
* O impacto ambiental causado pelo descarte incorreto das pilhas e baterias usadas;
* A eficiência energética desses dispositivos;
* Processos de reciclagem pelos quais os materiais contidos nas pilhas, baterias, latas de alumínio, lixo eletrônico e outros podem passar;
* Os processos de síntese do alumínio e de outros metais importantes;
* Corrosão e proteção dos metais;
* E outros aspectos relacionados com a aplicação da eletrólise, como a eletrólise de purificação, metais de sacrifício e a galvanoplastia.
Esses aspectos podem ser mencionados e cabe ao candidato saber interpretar as situações dadas para extrair as informações teóricas que são estudadas em Eletroquímica para resolver a questão. Alguns conteúdos e conceitos importantes de Eletroquímica que você deve estudar são:
* Pilhas e baterias;
* Oxidação e redução;
* Agente redutor e agente oxidante;
* Ânodo e cátodo;
*Potencial-padrão de redução das pilhas;
*Eletrólise ígnea e eletrólise em meio aquoso.
Esses e outros conceitos importantes podem ser estudados por meio dos textos da seção Eletroquímica.
Agora vejamos exemplos de como esses conteúdos de Eletroquímicas foram cobrados em anos anteriores no Enem:
Exemplo 1: Enem – 2009 – Caderno azul:

Questão 15 do Enem 2009 no caderno azul
Resolução:
Alternativa correta é a letra “b”.
Força redutora é a tendência que um metal tem de sofrer oxidação (perder elétrons) e provocar a redução de outra espécie química. Assim, a facilidade desse metal de perder elétrons deve ser maior que a do outro elemento, ou seja, ter maior força redutora.
As impurezas metálicas que se sedimentam abaixo do ânodo de cobre não devem sofrer oxidação, pois, caso isso ocorresse, passariam à solução. Elas devem possuir, então, uma menor força redutora que o cobre. No enunciado, a força redutora cresce de cima para baixo, logo, os metais que se sedimentam são o ouro, a platina e a prata.
Exemplo 2: Enem – 2010 – Caderno azul:
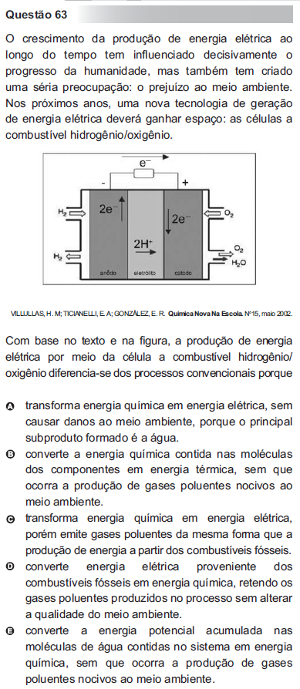
Questão 63 do Enem 2010 no caderno azul
Resolução:
Alternativa correta é a letra “a”.
Conforme explicado no texto Pilha de Combustível, nessas células o ânodo (polo negativo) que perderá os elétrons será o gás hidrogênio, e o cátodo (polo positivo) que receberá os elétrons será o gás oxigênio. Portanto, temos como semirreações e reação global nessa pilha:
Ânodo: 2 H2 + 4 OH- → 4 H2O + 4e-
Cátodo: O2 + 2 H2O + 4e- → 4 OH
Global: 2 H2 + O2 → 2 H2O
Assim, esse processo de produção de energia elétrica diferencia-se dos concencionais porque há transformação de energia química em energia elétrica, com formação de água.
Exemplo 3: Enem – 2012 – caderno azul:
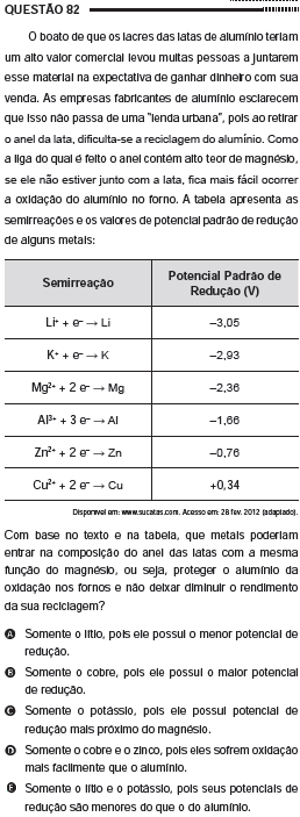
Questão 82 do Enem 2012 no caderno azul Título: Questão 82 do Enem 2012
Resolução:
Alternativa correta é a letra “e”.
O magnésio funciona como metal de sacrifício, ou seja, ele oxida no lugar do alumínio. Ao analisar os potenciais-padrão de redução desses dois metais, temos:
Mg2+ + 2 e- → Mg E0R= -2,36 V
Al3+ + 3 e- → Al E0R= -1,66 V
Veja que o potencial-padrão de redução do magnésio (-2,36 V) é menor que o do alumínio (-1,66 V), o que significa que ele possui maior tendência de oxidar (e menor tendência de reduzir). Por isso, ele oxida no lugar do alumínio, protegendo-o.
Assim, para que um metal possa servir como metal de sacrifício do alumínio, é preciso que ele tenha o potencial-padrão de redução menor que o desse metal. Além do magnésio, os únicos metais alistados na tabela que possuem o potencial-padrão de redução menor que o do alumínio são o lítio (Li) e o potássio (K).







